在《新型仿生纳米药物递送系统:细胞外囊泡载药策略及应用》中我们对细胞外囊泡的形成过程、常见载药策略及应用做了简要介绍,其中外泌体因免疫原性低、稳定性好、传递效率高、能跨越血脑屏障等特点更加适合作为药物纳米递送载体[1],本期将以外泌体为例进一步介绍细胞外囊泡靶向给药及如何增强其靶向性。
目前外泌体靶向给药系统多是在其内部负载各种药物分子(如核酸、病毒蛋白、化学药物等),被动靶向或另在其表面增加靶向分子或其他方式,使其靶向至特定的细胞或组织内发挥作用。实际应用中研究者需要根据所负载药物的不同性质及所选用的不同细胞的外泌体特点设计靶向给药系统。下面就文献中的几种外泌体靶向给药系统为例作简要介绍:被动靶向 给药系统
目前已证明单核细胞来源的骨髓细胞活化所介导的炎症过程在大多数慢性疾病的发展过程中起主要作用,而姜黄素作为常用的抗炎症药物,疏水性强且具有与脂质膜优先作用的特点,导致其生物利用度低、临床疗效差。有研究表明活化的骨髓细胞对于外周血中循环的外泌体具有很强的吞噬作用。
基于以上内容,研究者将外泌体与姜黄素孵育获得包含姜黄素的载体,经注射或口服的方式进入到小鼠体内,在外周血循环的过程中被活化的骨髓细胞吞噬,以提高增加姜黄素的溶解度、稳定性和生物利用度,并增强其抗炎活性[2]。
02 抑制外泌体被肝脏和脾脏的吞噬细胞摄取,提高外泌体被动靶向的效率虽然外泌体正在成为一种有希望的药物递送载体,但是机体内单核吞噬细胞系统(如肝脏、脾脏等)对外泌体的快速吸收仍然是药物进入包括心脏在内的其他靶器官的障碍,因此如何减少外泌体在肝脏和脾脏等器官的非特异性积聚成为提高外泌体向心脏和其他器官药物递送效率的一个重要方向。
第四军医大学的研究人员发现网格蛋白重链1(Cltc)在介导肝脏和脾脏外泌体的内吞作用中起着重要作用,研究人员首先采用阿霉素诱导心脏损伤的小鼠模型,再将负载siRNA的阻断性外泌体经小鼠尾静脉注入以干扰Cltc的表达,然后再将负载miR-21a-5p(对心脏有保护作用的miRNA)的治疗性外泌体经小鼠尾静脉注入体内,可明显减少治疗性外泌体在肝脏和脾脏的积聚,显著改善外泌体被动递送miR-21a-5p至心脏的效率[3]。
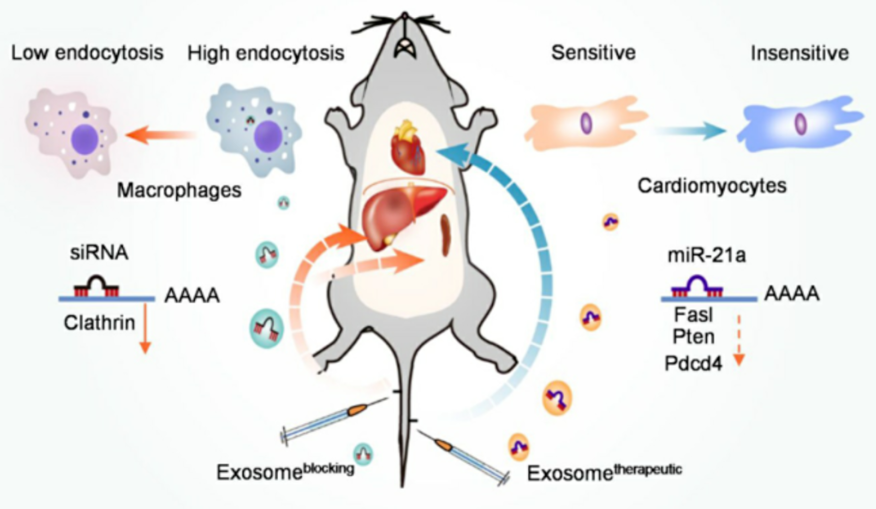
图1. 采用阻断性外泌体预处理可显著抑制肝脏脾脏对治疗性外泌体的吞噬,提高治疗性外泌体的被动靶向效率[3]
目前缺血性脑卒中治疗的主要障碍是药物无法安全有效的递送,外泌体因具有低免疫原性、先天稳定性、高传递效率和跨越血脑屏障的能力,被认为可以作为缺血性脑卒中治疗的药物递送载体,然而外泌体靶向的能力不足限制了其临床应用。此外研究发现特异性阻断整合素αVβ3与其配体的结合可以对缺血性脑组织起到保护作用。
南京医科大学的研究者采用两步法在分离出的外泌体表面修饰c(RGDyK),这一靶向肽对缺血性脑卒中治疗的新靶点整合素αVβ3具有高亲和性和选择性,可阻断αVβ3与配体的结合,同时研究者将外泌体与姜黄素孵育,获得兼具靶向性和治疗作用的外泌体药物递送载体[4]。

图2.利用化学方法在外泌体表面修饰c(RGDyK)靶向肽,以增加其主动靶向的能力[4]
02 制备负载磁性纳米颗粒的外泌体,使其具有磁靶向的能力
天津大学研究人员采用表面偶联转铁蛋白的超顺磁性Fe3O4纳米颗粒捕获血液中带转铁蛋白受体的外泌体,并将磁性外泌体与阿霉素共孵育获得“磁化”并载药的外泌体,不仅解决了外泌体难提取的问题,也使外泌体兼具磁靶向性和抗肿瘤药物特性,可在外磁场的作用下实现对肿瘤部位的靶向,释放阿霉素杀死肿瘤细胞[5]。
这种“磁化”的外泌体载药系统既包含外泌体本身的被动靶向,又包含主动的磁靶向,从而有利于外泌体逃避肝、脾、肾等器官的清除,实现阿霉素在肿瘤部位的富集,为肿瘤靶向治疗提供了新思路。
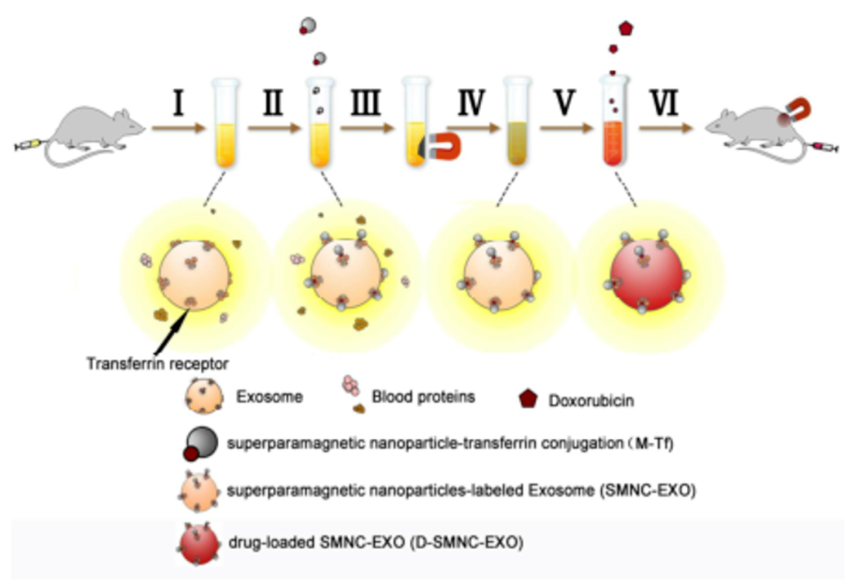
图3. “磁化”并载抗肿瘤药物阿霉素的外泌体递药系统兼具被动和主动靶向的能力[5]
03 通过改造母细胞,增加外泌体靶向配体的表达量,提高其靶向能力慢性髓系细胞白血病发病的必要条件是BCR-ABL1的融合基因诱导酪氨酸激酶的组成性激活,从而导致不受控制的细胞增殖。
为解决BCR-ABL1的选择性抑制剂如伊马替尼等,在改善慢性髓系白血病患者预后的同时带来的获得性耐药和长期不良反应,基于核酸的基因表达抑制剂如siRNA,开始用于慢性髓系白血病的治疗,但因缺乏合适的给药系统而阻碍了临床应用,而外泌体载药系统的出现为这一问题的解决提供了新的方案。
另外IL3-R受体在慢性髓系白血病的造血干细胞中过表达而在正常造血干细胞中低表达或不表达, 使IL3-R成为该病药物传递系统的受体靶点。研究人员采用包含人重组IL3-Lamp2b基因的质粒感染HEK293T细胞,再分别采用伊马替尼处理细胞或BCR-ABL1 siRNA转染细胞以获得高表达IL3配体并负载伊马替尼的外泌体或高表达IL3配体并负载siRNA的外泌体。利用改造后可靶向IL3受体的外泌体直接靶向肿瘤细胞达到抗癌效果[6]。
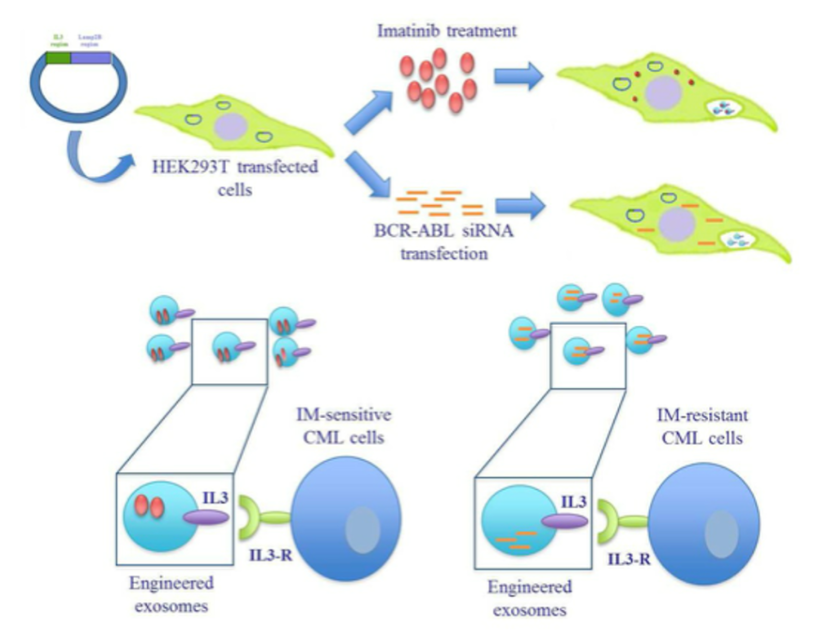
图4.通过改造母细胞获得高表达IL3配体的外泌体,增强其主动靶向性[6]
04 通过外泌体与携带靶向分子的脂质体融合,提高外泌体的主动靶向能力
脂质体作为一类人工合成的外部为脂质双分子层、内部为水相的闭合囊泡,具有生物膜的功能和特性,能够有效包裹药物分子、光敏剂、造影剂等(更多详情请点击往期文章《脂质体载药纳米技术》),并可通过在其表面修饰PEG分子增加脂质体在体内的循环时间以调控药物的释放,亦可修饰各种靶向分子,与外泌体相比各有优势。为将外泌体与脂质体的优势结合在一起,研究人员将制备的脂质体与提取的外泌体在PEG的介导下完成了融合,制备出一种杂合囊泡,降低了巨噬细胞的原位内吞并提高了向肿瘤细胞递送药物的效率,为药物递送提供一种新的思路[7]。
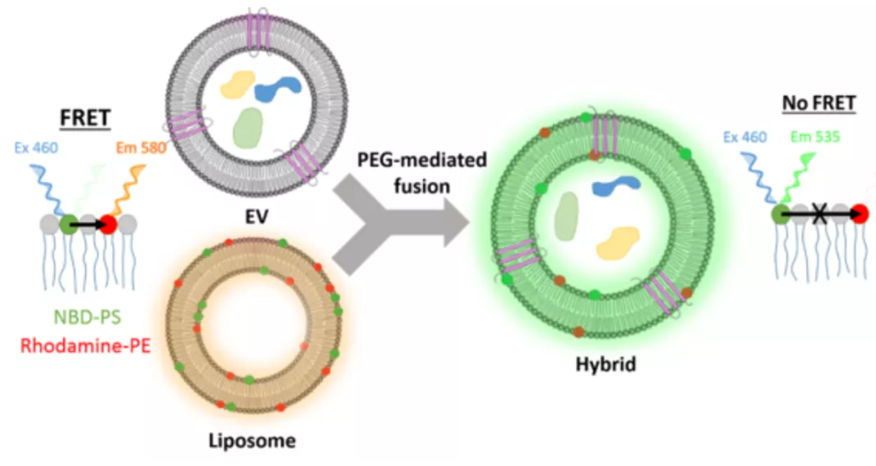
图5.脂质体与外泌体在PEG的介导下完成融合,形成新的杂合囊泡[7]
本期以外泌体为例介绍了细胞外囊泡靶向给药及如何增强其靶向性,但因药物性质、疾病类型、不同细胞种类等诸多因素,外泌体靶向递药系统的设计较为复杂,本期只是介绍了几种设计方案,为各位研究者在靶向给药系统的设计中提供不同的思路。
[1] Tian, T., Zhang, H. X., He, C. P., Fan, S.,Zhu, Y. L., Qi,C., ... & Gao, J. (2018). Surface functionalized exosomes astargeted drugdelivery vehicles for cerebral ischemia therapy. Biomaterials, 150,137-149.
[2] Sun,D., Zhuang, X., Xiang, X., Liu, Y., Zhang, S., Liu, C., ... & Zhang, H.(2010). A Novel Nanoparticle Drug Delivery System: The Anti-inflammatoryActivity of Curcumin Is Enhanced When Encapsulated in Exosomes. MolecularTherapy, 18(9), 1606-1614.
[3] Wan,Z., Zhao, L., Lu, F., Gao, X., Dong, Y., Zhao, Y., ... & Liu, L. (2020).Mononuclear phagocyte system blockade improves therapeutic exosome delivery tothe myocardium.. Theranostics, 10(1), 218-230.
[4] Tian,T., Zhang, H., He, C., Fan, S., Zhu, Y., Qi, C., ... & Gao, J. (2018).Surface functionalized exosomes as targeted drug delivery vehicles for cerebralischemia therapy. Biomaterials,, 137-149.
[5] Qi,H., Liu, C., Long, L., Ren, Y., Zhang, S., Chang, X., ... & Kang, C.(2016). Blood Exosomes Endowed with Magnetic and Targeting Properties forCancer Therapy. ACS Nano, 10(3), 3323-3333.
[6] Bellavia,D., Raimondo, S., Calabrese, G., Forte, S., Cristaldi, M., Patinella, A., ...& Alessandro, R. (2017). Interleukin 3- receptor targeted exosomes inhibitin vitro and in vivo chronic myelogenous Leukemia cell growth. Theranostics,7(5), 1333-1345.
[7] Piffoux, M., Silva, A. K., Wilhelm, C.,Gazeau, F., & Tareste, D. (2018). Modification of Extracellular Vesicles byFusion with Liposomes for the Design of Personalized Biogenic Drug DeliverySystems. ACS Nano, 12(7), 6830-6842.