
研究背景:
肝细胞癌(HCC)是全球癌症死亡的主要原因。临床通常采用肝切除术、消融治疗、肝移植、介入灌注疗法及化疗等常规治疗方案。然而,肝癌死亡率仍呈逐年上升趋势。在肝癌研究领域,据报道DCR3 mRNA和蛋白在HepG2和SMCC7721(肝癌)细胞中高表达,而在LO2(正常肝)细胞中几乎检测不到。因此,DCR3有望成为小分子疗法的理想靶点,通过增强药物向肿瘤部位的递送效率,显著提升肿瘤治疗效果。四氧化三铁(Fe3O4)纳米颗粒作为最传统的磁性纳米材料,在生物医学领域尤其是靶向药物/基因递送系统中备受关注,这得益于其卓越的磁学性能、生物相容性、低毒性、可生物降解性及其他优势特性。很多研究表明磁性微机器人在生物医学应用中的潜力日益凸显,为癌症治疗提供了精准靶向、可控药物递送和创新治疗策略。
研究内容:
该研究提出了一种兼具磁驱运动与化学趋化行为的双响应纳米颗粒,该颗粒能够沿血液和组织中的DCR3蛋白梯度定向迁移,从而有效靶向体内肝脏肿瘤部位(图1)。通过聚乙二醇修饰的30 nm Fe3O4(Fe NPs)(购于南京东纳生物,货号:Mag3200)利用粒子间的磁相互作用,在特殊磁场控制下形成集群实现磁靶向;将铁纳米粒子(Fe NPs)与DCR3抗体偶联得到Fe NPs-DCR3,进一步提升了药物向肿瘤部位递送的精准性。并通过体内体外实验证明Fe NPs-DCR3相比于单独的Fe NPs具有更好的靶向作用,为今后的精准靶向治疗提供新的途径。工作发表在Small(IF=12.1)。
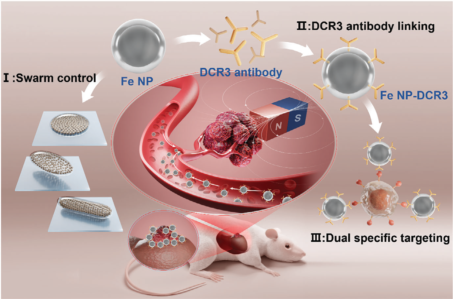
图1 纳米颗粒的制备及其高效靶向效应
研究人员将Fe NPs与DCR3抗体进行偶联,构建出Fe NPs-DCR3复合物。该复合物具有独特靶向能力:Fe NPs在磁场作用下可形成涡旋状纳米机器人集群(VNS),能够在复杂环境中精确定位;DCR3抗体能特异性识别并结合在肝癌细胞中显著高表达的DCR3位点。既具备DCR3抗体的生物靶向性,又保留磁靶向功能,实现了对肝脏肿瘤的高度精准打击。
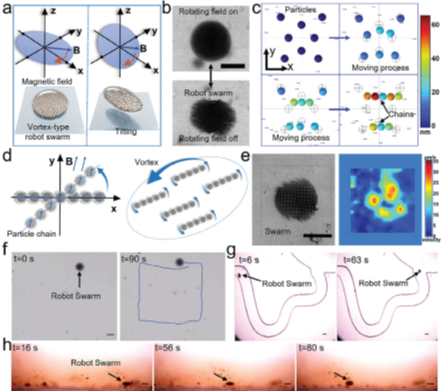
图2 Fe NPs在螺旋磁场作用下的行为
Fe NPs间的磁相互作用可在特定外加磁场作用下,使它们在液体环境中呈现出集群行为。通过外加磁场可以对Fe NPs进行控制,实现靶向递送。
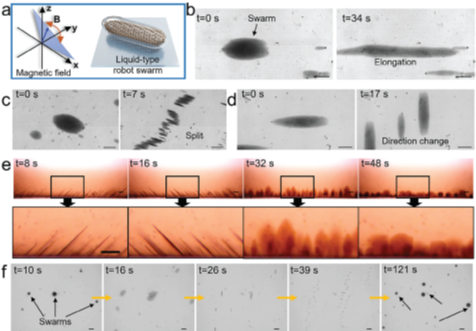
图3 Fe NPs在振荡磁场作用下的行为
Fe NPs在振荡磁场中可以形成液态集群,展现出类流体的可变形特性,通过磁场可控制集群的方向与行动。
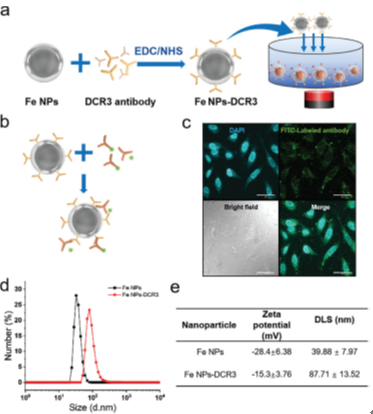
图4 Fe NPs-DCR3抗体的制备与表征
研究中采用碳二亚胺法将DCR3抗体(可特异性结合DCR3蛋白)与Fe NPs偶联,构建了Fe NPs-DCR3复合物。并通过DLS、Zeta、荧光标记证明DCR3抗体偶联成功。
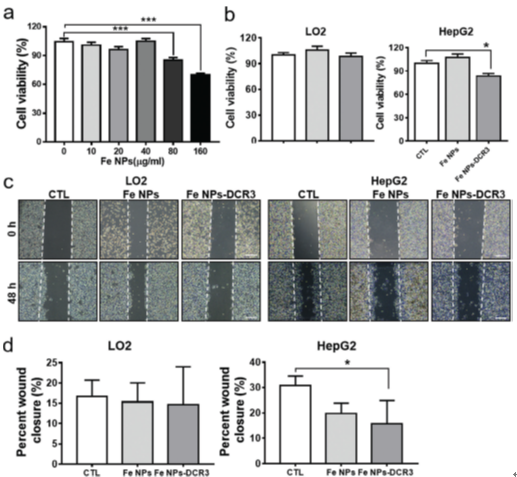
图5 Fe NPs-DCR3对于HepG2细胞活性以及迁移的影响
采用Cell Counting Kit-8(CCK8)试剂盒评估了铁纳米颗粒(Fe NPs)对正常肝细胞的细胞毒性作用以及Fe NPs-DCR3对于正常肝细胞以及肝癌细胞的细胞毒性作用。40 μg/mL的Fe NPs对于正常干细胞无明显毒性;Fe NPs-DCN对于正常细胞无明显毒性,对于HepG2细胞(肝癌细胞系)具有细胞毒性。细胞划痕实验表明Fe NPs-DCR3可以抑制HepG2细胞的迁移。
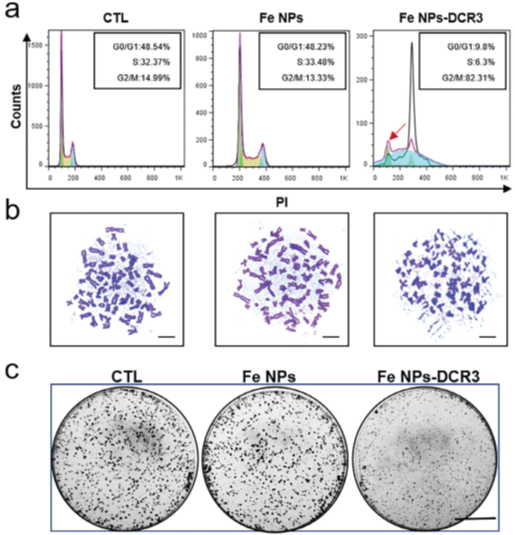
图6 Fe NPs-DCR3对于细胞形成周期以及细胞增殖的影响
与Fe NPs组和对照组(CTL)相比,Fe NPs-DCR3处理组的细胞数量显著减少,凋亡细胞数量增加。与CTL组相比,Fe NPs处理对HepG2细胞增殖无显著影响,Fe NPs-DCR3处理组的细胞数量明显减少,且该组细胞形态明显小于其他两组。证明DCR3能抑制HepG2细胞增殖。
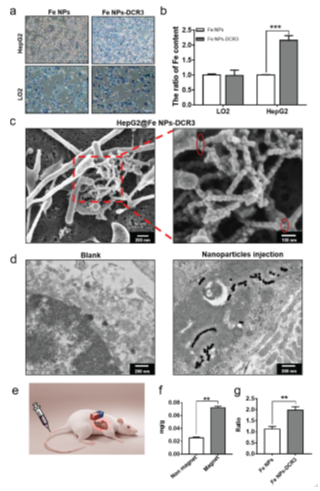
图7 Fe NPs-DCR3的生物靶向性能
未施加外部磁场时,初步观察显示Fe NPs主要分布于肝脏和脾脏,心脏中有微量分布,而肺部和肾脏未见明显聚集。当对肝脏区域施加外部磁场后,我们观察到肝脏和脾脏中Fe NPs的聚集量显著;增加偶联DCR3抗体后,Fe NPs-DCR3组在肝肿瘤部位的富集效果优于Fe NPs组。这些结果充分证明Fe NPs-DCR3能在体内实现肝肿瘤的有效靶向。
研究总结:
此研究提出了一种利用双响应性磁性纳米粒子进行肝细胞癌(HCC)靶向治疗的新策略。通过将铁纳米粒子(Fe NPs)与DCR3抗体偶联,显著提升了药物向肿瘤部位递送的精准性。研究中的核心创新在于DCR3抗体靶向与磁场操纵的协同效应,由此构建出一种高效针对肝癌的靶向治疗策略。体内外实验均验证了Fe NPs-DCR3能够特异性识别并结合过表达DCR3的肝癌细胞,从而有效抑制细胞活力、迁移和增殖。此外,体内研究显示Fe NPs-DCR3可有效富集于肝脏肿瘤区域,并在施加磁场周围出现显著铁聚集现象。此研究为基于磁性纳米粒子的药物递送系统提供了新的视角,拓展了利用外磁场调控纳米粒子体内行为以实现无创靶向肿瘤治疗的新途径。
参考文献:
Jia L, Dai Y, Xu Y, et al. Dual Responsive Magnetic DCR3 Nanoparticles: A New Strategy for Efficiently Targeting Hepatocellular Carcinoma[J]. Small, 2025, 21(12): 2402909.
产品推荐:
货号 | 产品名称 | 溶剂 | 表面基团 | 浓度 | 粒径 |
Mag3200 | PEG化四氧化三铁磁性纳米颗粒 | 超纯水 | COOH | 1 mg/mL | 5-50 nm |
Mag3300 | PEG化四氧化三铁磁性纳米颗粒 | 超纯水 | NH2 | 1 mg/mL | 5-50 nm |