
葡聚糖修饰磁性纳米簇(Dextran-coated magnetic nanoclusters)结合了葡聚糖的生物相容性和磁性纳米颗粒的独特物理性质,在生物医学、环境科学等领域展现出显著优势和应用潜力。
南京东纳生物科技有限公司推出葡聚糖修饰磁性纳米簇,尺寸覆盖10 nm-80 nm,是具有“纳米花”结构的超顺磁性纳米颗粒。葡聚糖修饰磁性纳米簇具有更强的磁性、更高的稳定性、良好的生物相容性以及抗非特异性吸附等特点,可与特异性靶向识别分子(如抗体、适配体、靶向肽等)共价偶联,构建靶向纳米探针,用于磁靶向、磁热疗、细胞分选等生物医学领域。

图1. 葡聚糖修饰磁性纳米簇的TEM图
<产品信息>
<产品优势>
l 优异的生物相容性
l 增强的胶体稳定性
l 磁响应性可控
<应用方向>
l 磁热疗
l 生物分离与纯化
l 生物成像与传感器
l 细胞分选与标记
l 磁共振成像造影剂
<应用实例1>
葡聚糖修饰磁性纳米簇用于T细胞治疗
T细胞介导的炎症与器官移植排斥、COVID-19引发的细胞因子释放综合征等疾病紧密关联,会对机体造成严重损害,诱导免疫耐受是减轻该炎症的关键所在。抗CD3单克隆抗体(mAb)在诱导免疫耐受过程中发挥着重要作用,然而单独使用抗CD3 mAb存在不良反应和安全性问题,因此研究人员将抗CD3 mAb偶联到葡聚糖修饰的磁性纳米簇(MNPs)表面制备出Ab-MNPs,在刀豆蛋白A(ConA)诱导的小鼠炎症模型实验中,给小鼠提前使用不同剂量的Ab-MNPs,与单独使用MNPs或抗CD3 mAb相比,预先给予Ab-MNPs能显著降低ConA处理后小鼠血清中的干扰素-γ和白细胞介素-6水平,有效抑制炎症反应;透皮贴片递送也有类似的效果,而单独使用MNPs或抗CD3 mAb则效果不佳。Ab-MNPs在抑制T细胞介导的炎症反应方面展现出巨大的潜力,有望成为治疗器官移植、COVID-19等相关疾病的创新疗法,为临床治疗这类疾病提供新的方向和解决方案[1]。
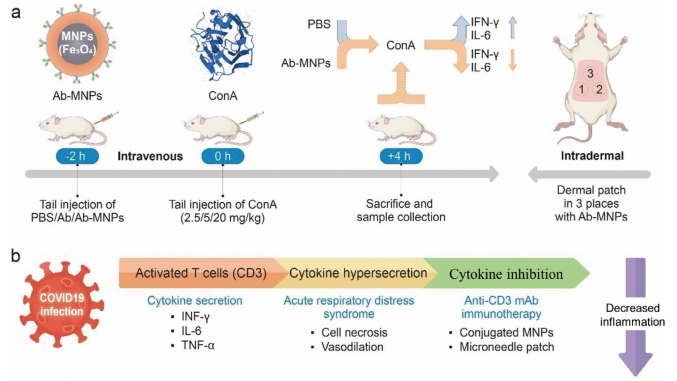
图2. 在啮齿动物炎症模型中,用Ab-MNPs激活T细胞介导的高炎症和免疫治疗的示意图
<应用实例2>
葡聚糖修饰磁性纳米簇用于MRI造影剂
在追求用于诊断和治疗应用的磁性纳米颗粒优化过程中,纳米粒子结构的作用一直被忽视。在这项研究中,研究人员证明了多核氧化铁纳米簇的内部集体组织可以调节其磁性特性,从而极大地提高其热效应和MRI T1和T2对比效果。与单个磁核相比,多个磁核的三维定向附着导致磁化率增强和表面无序减少,同时保持了多核结构的超顺磁性行为,并加剧了热损耗。多核纳米簇的交换耦合改变了磁矩的动力学,使得纵向和横向核磁共振弛豫率也得到了增强。由于这些氧化铁纳米结构易于吸收且无毒,因此可以通过磁热疗实现对肿瘤细胞的长期MRI检测及其有效破坏。这项研究首次证明,在保持生物相容性的前提下,高度结晶的氧化铁超顺磁性多核纳米簇内的协同磁性行为可以同时提高治疗和诊断效果[2]。
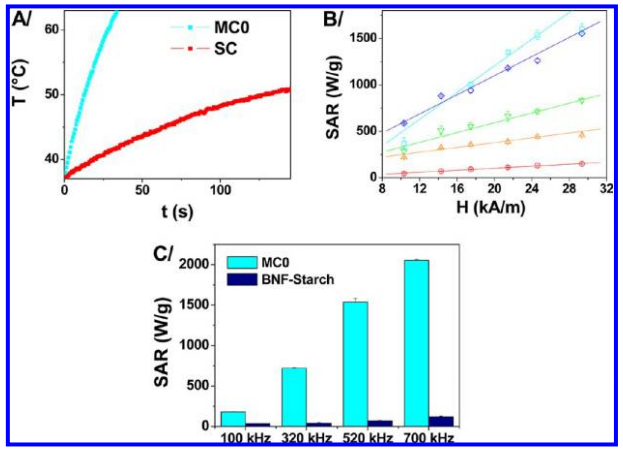
图3. 不同样品的磁热性能。(A)MC0(多核)和SC(单核)样品在铁中浓度分别为0.087和0.081 mM时的加热曲线。温度每0.7秒记录一次,在替代磁场H= 29 kA/m下,频率f = 520 kHz。 (B)MC0(青色)、MC1(蓝色)、MC2(绿色)、MC3(橙色)和SC(红色)在频率f = 520 kHz下的SAR值随施加磁场的变化。(C)在磁场μ0H = 25 kA/m下,MC0与BNF-starch在不同频率下的SAR值比较
<应用实例3>
葡聚糖修饰磁性纳米簇用于磁热疗
转移是实体器官恶性肿瘤导致死亡的主要原因。然而,目前的抗癌药物在应对转移性癌症方面的疗效并不理想。莱斯大学Gang Bao教授报道了一种纳米治疗方法,将磁性纳米簇热疗和自由基生成与免疫检查点阻断(ICB)相结合,能够有效抑制原发性和继发性肿瘤。
研究人员将2,2’-偶氮二(2-异丁基脒)二盐酸盐(AAPH)分子包覆在磁性氧化铁纳米团簇(IONCs)上形成IONC–AAPH。IONC可以在交变磁场(AMF)下产生高水平的局域热,从而分解纳米簇表面的AAPH并产生大量碳中心自由基,磁加热与自由基结合导致肿瘤细胞死亡,导致多种损伤相关分子的释放或暴露,促进树突细胞成熟。研究发现,IONC–AAPH在AMF作用下治疗荷瘤小鼠,可在根除肿瘤的同时引起全身抗肿瘤免疫反应;另外在AMF下,IONC-AAPH联合抗PD-1免疫检查点封锁疗法可显著抑制未治疗远处肿瘤的生长并诱导长期免疫记忆。这种基于IONC–AAPH的磁免疫疗法具有有效对抗肿瘤转移和控制复发的潜力[3]。
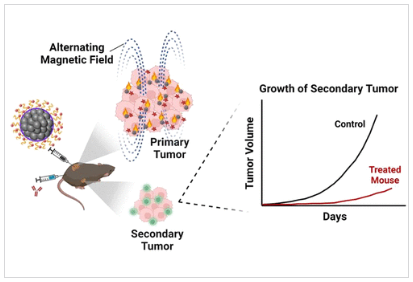
图4. 磁性纳米簇用于肿瘤治疗的示意图
参考文献
[1] Hasan, M., Choi, J. G., Akter, H., Kang, H., Ahn, M., & Lee, S. S. (2024). Antibody‐Conjugated Magnetic Nanoparticle Therapy for Inhibiting T‐Cell Mediated Inflammation. Advanced Science, 11(11), 2307148.
[2] Lartigue, L., Hugounenq, P., Alloyeau, D., Clarke, S. P., Lévy, M., Bacri, J. C., ... & Gazeau, F. (2012). Cooperative organization in iron oxide multi-core nanoparticles potentiates their efficiency as heating mediators and MRI contrast agents. ACS nano, 6(12), 10935-10949.
[3] Zhang, L., Zhang, Q., Hinojosa, D. T., Jiang, K., Pham, Q. K., **ao, Z., ... & Bao, G. (2022). Multifunctional magnetic nanoclusters can induce immunogenic cell death and suppress tumor recurrence and metastasis. ACS nano, 16(11), 18538-18554.

